Внешние оболочки Земли
Экспериментально установлено, что протон в воде может быть только гидратированным. Гидратация не исчерпывается реакцией H+ + H2O = H3O+. Последовательно может присоединиться несколько молекул воды:
![]()
Исходя из постоянства произведения ионов H+ и OH-, образующихся при диссоциации H2O = H+ + OH-, важнейшим критерием поддержания жизнеспособности условий в воде и почве является узкий интервал изменений водородного показателя (pH) в пределах 6-9. В природной воде прежде всего растворяются газы атмосферы: O2, N2 (рис.2) и CO2.
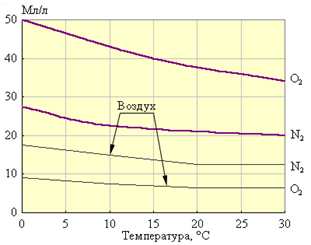
Рис.3 Растворимость
Хотя растворимость кислорода в два раза больше растворимости азота, но из-за большего парциального давления (78%) в природной (дождевой) воде азота растворено в два раза больше, чем кислорода. Минерализация воды приводит к уменьшению растворимости воздуха. Так, при 0 °С растворимость кислорода (чистого) составляет 49 мл/л, а морской воде только 15 мл/л. Необходимое для окисления растворимых в воде веществ количество кислорода называется биохимической потребностью в кислороде (БПК).
Так, чистая вода, вытекающая из-под ледников, имеет БПК < 1 млн-1, пригодная для питья - < 5 млн-1, а канализационная - 100-500 млн-1.
Большую проблему создают попадающие в водоемы нитраты и фосфаты, поскольку они при неумелом использовании вызывают заболевание малопроточных водоемов и прудов.
Растворение CO2 в воде сопровождается химическим взаимодействием с установлением равновесия:
![]()
K1 = 4,5 · 10-7, K2 = 5,6 · 10-11.
Обычные методы измерения констант диссоциации не позволяют отличить растворенный CO2 от H2CO3 в растворе. Так как равновесие устанавливается быстро, то за контанту равновесия этой реакции Kравн = [H2CO3] / [CO2] ∙ [H2O] обычно принимают первую константу диссоциации угольной кислоты (K1 = 4,5 · 10-7). Вместе с тем найдено, что H2CO3/CO2 = 0,0037; это означает, что только 0,37% растворенного CO2 находится в виде H2CO3. Если бы весь растворенный CO2 находился в виде H2CO3, то K1 = 1,8 · 10-4, что позволяет отнести H2CO3 к умеренно сильным кислотам. Практически из-за быстрого установления равновесия гидратации CO2 приходится пользоваться не действительной константой диссоциации K1 = 1,8 · 10-4, а кажущейся K1 = [H+] ∙ [H2CO3] / CO2 = 4,5 ∙ 10-7, относящейся к реакции CO2 ∙ H2O = H+ + HCO3-.
Другим источником поступления карбонат - и бикарбонат-ионов являются карбонаты:
![]()

Равновесие, устанавливающееся между H2CO3 и бикарбонат-ионом, определяет буферную емкость природных вод, что очень важно для поддержания постоянства в них pH.
PH почвенных вод может колебаться от 3 до 10. Однако кислотность почв, благоприятных для произрастания растений, мало отличаются от pH = 6. Морские организмы еще более чувствительны к pH среды обитания. Океаническая вода имеет pH = 8, а pH прибрежных вод ≈ 9. При pH < 7,5 многие морские организмы погибают. При pH < 7,0 морские организмы уже не в состоянии образовывать карбонатные скелеты.
С глубиной концентрация Ca2+ снижается, что способствует растворению CaCO3, составляющего основу раковин и скелетных тканей отмерших организмов.
Кроме Ca 2+и HCO3 - морская вода содержит катионы: Na+, K+, Mg2+, Fe3+,
Mn2+ и анионы Cl-, Br-, I-, SO4 2 - определяющие ее соленость (S). За величину солености принят вес сухого остатка после упаривания 1 кг морской воды и перевода карбонатов в оксиды, бромидов, иодидов в хлориды, а органические вещества сожжены при 480 °C. Соленость измеряется в г/кг или промилле (‰).
Другие статьи:
Возможности организации музыкального воспитания школьников в летнем лагере
Музыкальное воспитание – целенаправленное и систематическое развитие музыкальной культуры, музыкальных способностей человека, воспитание в нём эмоциональной отзывчивости к музыке, понимания и глубокого переживания её содержания. Музыкальное воспитание есть процесс передачи общественно-исторического опыта муз ...
Способы изготовления игрушек с подвижными частями. Материалы, оборудование,
инструменты
Непременными компонентами деятельности являются разнообразные навыки и умения. Об их соотношении высказываются различные мнения. Одни исследователи считают, что навыки предшествуют умениям, другие полагают, что умения возникают раньше навыков. Причиной этих расхождений является многозначность слова «умение». ...
Главные разделы
- Главная
- Профессиональное самоопределение школьников
- Воспитание этнической толерантности в школе
- Понятие и технология обучения
- Образовательные технологии
- Оптимизация системы образования
- Изучение информационных технологий в школе
- Педагогика как наука

